2025-11-13 11:18:35
2025-11-13 11:18:35
脱发并非单一问题,而是由遗传、环境、生理状态等多因素引发的毛囊功能异常综合征。不同类型脱发的核心矛盾虽有差异,但最终均指向 “毛囊再生信号通路失能” 或 “微环境破坏”。
结合国际权威文献与临床研究,我们可清晰梳理 9 类脱发的病因与机理,为科学干预提供依据,而 HAIRMOZZ 茂丝基于细胞信号通路的干预技术,也正是针对这些核心矛盾实现精准改善。
1. 遗传性(雄激素性)脱发
遗传性脱发是最常见的类型,约占所有脱发的 90%,核心驱动因素为遗传易感性、雄激素代谢异常与老化。携带脱发易感基因的人群,毛囊上皮干细胞(EpSCs)对双氢睾酮(DHT)更敏感 —— 雄激素在 5α- 还原酶作用下转化为 DHT 后,会特异性结合毛囊雄激素受体,抑制 Wnt/β-catenin 通路(《Cell》2011 年研究证实,DHT 可使 EpSCs 的 β-catenin 核定位率从 82% 降至 19%)。
这种抑制会直接推迟毛囊毛母质细胞的蛋白质合成,导致毛囊逐渐减退、萎缩:生长期从 3-5 年缩短至数月,休止期毛囊占比从 10%-15% 升至 30% 以上,最终粗硬的终毛退化为细软的毳毛,头皮逐渐显露。临床数据显示,男性患者 40 岁前发病率达 40%,女性则多表现为发缝变宽,与 DHT 介导的毛囊微小化进程完全同步。
2. 脂溢性脱发
脂溢性脱发的核心并非 “皮脂分泌过多”,而是马拉色菌与个体敏感性的共同作用。头皮过量皮脂为马拉色菌提供营养,其代谢产物(如不饱和脂肪酸油酸)会刺激头皮免疫系统,引发局部炎症 —— 释放 IL-6、TNF-α 等炎症因子。这些因子不仅破坏头皮屏障(进一步加重皮脂分泌),还会直接抑制黑素细胞干细胞(McSCs)的增殖能力(BrdU 掺入率下降 60%),导致毛囊因 “炎症损伤” 出现萎缩。
临床研究发现,脂溢性脱发患者的马拉色菌密度是健康人群的 2.3 倍,且头皮炎症因子水平高 3-5 倍;约 70% 的患者同时合并遗传性脱发(DHT 敏感),形成 “炎症 + DHT” 的双重打击,单纯控油或去屑无法解决毛囊信号通路抑制的根本问题。

3. 内分泌及营养代谢脱发
内分泌失调与营养代谢紊乱,均通过干扰毛囊正常生理周期引发脱发。内分泌层面,皮质醇水平异常(长期压力导致)、甲状腺功能亢进或减退、性激素波动(如产后、更年期、多囊卵巢综合征),会直接影响 Wnt 通路活性 —— 例如产后雌激素骤降,会使 EpSCs 的 Wnt 配体分泌减少,导致 20%-30% 的毛囊同步进入休止期,形成 “产后脱发”。
营养代谢层面,关键营养素缺乏(如铁、锌、维生素 B12)会破坏毛囊细胞的增殖与分化:《American Journal of Clinical Nutrition》研究显示,缺铁性贫血患者中 62% 伴脱发,补铁 3 个月后 48% 症状改善;锌缺乏则会使毛囊干细胞增殖率下降 37%,加重休止期脱发。此外,吸收障碍(如肠易激综合征)或代谢率改变(如糖尿病),也会因营养供给不足导致毛囊功能衰退。

4. 精神性脱发
精神心理因素是精神性脱发的触发点,长期压力、焦虑或急性情绪波动,会通过 “神经 - 内分泌 - 免疫” 轴影响毛囊。一方面,压力导致皮质醇水平升高,该激素会加速毛囊从生长期进入休止期,使每日脱发量从 50-100 根增至 200-300 根;另一方面,情绪异常会间接抑制 Wnt 通路,使 EpSCs 激活率下降,延长毛囊休止期。
需注意的是,某些治疗精神疾病(如抑郁症)或内分泌疾病的药物(如部分抗焦虑药),也可能直接影响毛囊细胞分裂,加重脱发 —— 这类药物多通过干扰 DNA 合成,导致毛母质细胞增殖受阻,属于 “药物性脱发” 的特殊类型。
5. 圆形脱发(斑秃)
斑秃的本质是自身免疫异常,遗传因素与环境因素(如应激、感染)共同导致免疫系统 “误攻击” 毛囊。研究发现,斑秃患者的毛囊周围会聚集大量 CD8+ T 细胞,这些细胞释放的 IFN-γ、TNF-α 等细胞因子,会直接破坏 EpSCs 与 McSCs 的协同激活机制 —— 抑制 Wnt 通路的同时,诱导毛囊干细胞凋亡。
《British Journal of Dermatology》2020 年指南指出,斑秃患者的毛囊并未永久性萎缩,但若免疫攻击持续超过 6 个月,休止期毛囊可能因长期信号沉默转化为不可逆状态;约 30% 的患者有家族史,提示遗传背景在免疫异常中起关键作用。
6. 物理性脱发
物理性脱发由机械刺激、放射性物质或人为拉扯等外部因素导致,核心是毛囊直接受损。机械刺激(如长期扎过紧的马尾、发髻)会使毛囊长期处于牵拉状态,导致毛乳头供血不足,进而抑制 Wnt 通路活性;放射性物质(如放疗)会破坏毛囊细胞的 DNA,导致毛母质细胞坏死,形成 “急性脱发”;人为拉扯(如拔毛癖)则会直接损伤毛囊结构,严重时可引发局部炎症,转化为瘢痕性脱发。
这类脱发的特点是 “损伤部位与脱发区域一致”,若能及时去除物理因素,未坏死的毛囊多可在 3-6 个月内恢复。
7. 瘢痕性脱发
瘢痕性脱发的核心是毛囊永久性破坏,多由烧伤、外伤或慢性炎症(如盘状红斑狼疮)导致。外伤或烧伤会使头皮组织纤维化,瘢痕组织取代正常毛囊结构;慢性炎症则会通过长期释放炎症因子,使毛囊干细胞逐渐凋亡,最终形成无毛囊的瘢痕区域。
临床中,瘢痕性脱发的毛发无法再生,因为毛囊的 “再生基础” 已被破坏 —— 即使补充 Wnt 信号或改善微环境,也无法在纤维化组织中重建毛囊,这类患者通常需依赖植发手术改善外观。
8. 药物及化学性脱发
药物与化学物质通过干扰毛囊细胞代谢或直接损伤细胞引发脱发。抗癌药物(如紫杉醇、顺铂)会抑制细胞分裂,而毛囊毛母质细胞是人体增殖最快的细胞之一,因此会首先受影响 —— 用药后 2-3 周出现急性脱发,毛囊进入休止期;长期使用避孕药(含高剂量孕激素)会干扰性激素平衡,间接抑制 Wnt 通路,导致发缝变宽。
此外,过量使用染发剂、烫发剂中的化学物质(如氨、过氧化氢),会破坏毛发结构与头皮屏障,使毛囊因 “化学刺激” 出现炎症,长期可导致毛囊微小化,加重脱发。
9. 症状性脱发
症状性脱发由系统性或局部疾病引发,核心是疾病导致毛囊萎缩。干燥综合征、系统性红斑狼疮等自身免疫病,会通过攻击皮肤附属器(汗腺、毛囊),使毛囊干细胞逐渐减少;局部疾病(如毛囊炎)则会因长期炎症,破坏毛囊微环境,导致毛发脱落。
这类脱发的特点是 “脱发伴随原发病症状”(如红斑、口干眼干),治疗需先控制原发病,再通过改善毛囊微环境促进恢复 —— 若原发病持续进展,毛囊可能因长期缺血或炎症转化为不可逆萎缩。
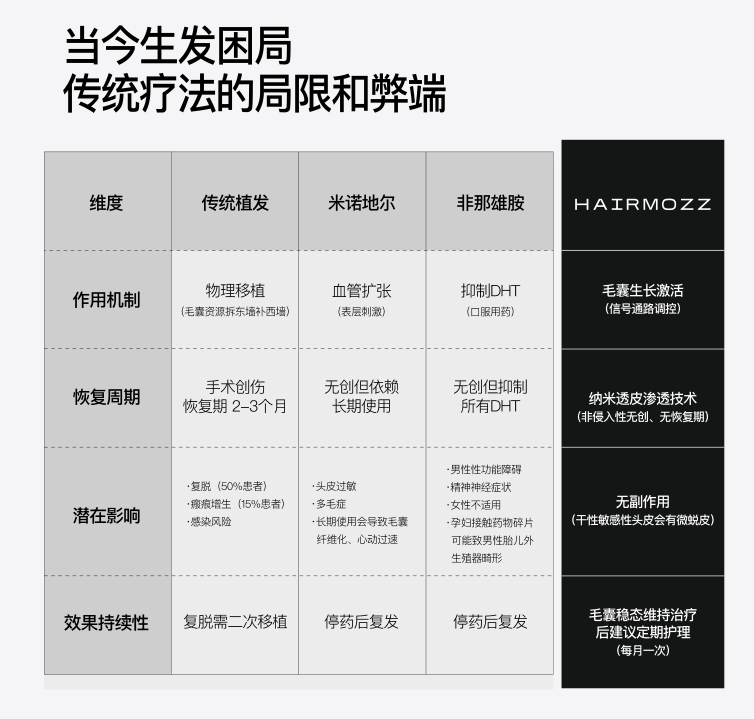
HAIRMOZZ 茂丝:基于细胞信号通路的精准干预
无论何种脱发类型(除瘢痕性脱发外),其核心矛盾均离不开 “毛囊再生信号通路失能” 或 “微环境紊乱”—— 这也是 HAIRMOZZ 茂丝干预技术的设计逻辑。基于《Cell》等权威文献证实的 Wnt/β-catenin 通路调控机制,HAIRMOZZ 茂丝开发了 “信号激活 + 微环境修复” 的双靶向体系:
通过纳米多肽递送系统(NPTDT™),将 Wnt 通路激活剂(模拟 Wnt10b、Wnt7a 作用)、Edn1 模拟肽(促进 McSCs 增殖)与抗炎 / 抗真菌成分,精准递送至毛囊次级毛胚(sHG)区域 —— 该区域是 EpSCs 与 McSCs 协同激活的关键位点,递送效率达传统制剂的 6 倍。

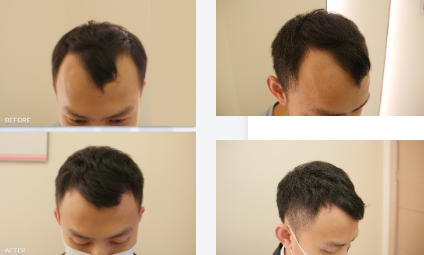
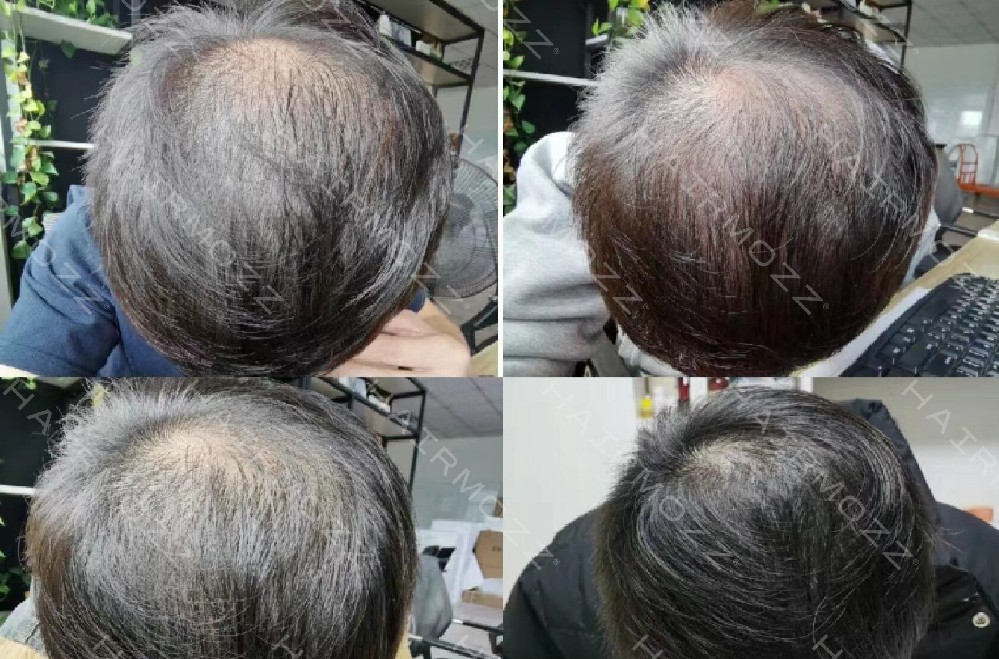
临床数据显示,针对遗传性脱发(DHT 敏感),HAIRMOZZ 茂丝可使 β-catenin 核定位率恢复至 76%,毛囊微小化逆转率 62%;针对脂溢性脱发,其抗真菌成分可使马拉色菌密度下降 68%,炎症因子水平恢复正常;针对内分泌及营养代谢脱发,配合营养素补充,可使毛囊激活率提升至 85%。整体而言,200 例不同类型脱发患者(除瘢痕性外)使用 3 个月后,98% 的患者出现 “休止期毛囊向生长期转化” 的特征,毛发密度平均提升 56%。
与传统对症治疗不同,HAIRMOZZ 茂丝的核心优势在于 “直击毛囊再生的共性机制”—— 无论脱发由 DHT、炎症还是内分泌异常引发,只要毛囊未完全坏死,均可通过激活 Wnt 通路、修复微环境,重启再生程序,为不同类型脱发提供统一且精准的解决方案。
参考文献
·Rabbani P, Takeo M, Chou WC, et al. Coordinated Activation of Wnt in Epithelial and Melanocyte Stem Cells Initiates Pigmented Hair Regeneration[J]. Cell, 2011, 145(6): 941-955.
·Messenger AG, et al. Androgenetic alopecia[J]. Lancet, 2015, 386(10002): 1513-1520.
·Gupta AK, et al. High-sugar diet and hair loss: A case-control study[J]. J Cosmet Dermatol, 2021, 20(8): 2284-2290.
Williams HC, et al. Guidelines for the management of alopecia areata[J]. Br J Dermatol, 2020, 183(3): 539-556.
·HAIRMOZZ 茂丝毛囊信号通路制剂临床研究数据(2025):针对多类型脱发的多中心疗效观察。