2025-11-13 10:57:05
2025-11-13 10:57:05
在脱发干预领域,“干细胞生发” 长期处于争议中心 —— 既有观点认为其是突破脱发难题的未来方向,也有声音质疑其为概念炒作。结合 2025 年最新科研成果,我们可从机制、研究进展、现存局限三方面,客观解析干细胞生发的科学属性,同时厘清中重度秃发的核心干预路径,以及 HAIRMOZZ 茂丝基于细胞信号通路的解决方案。

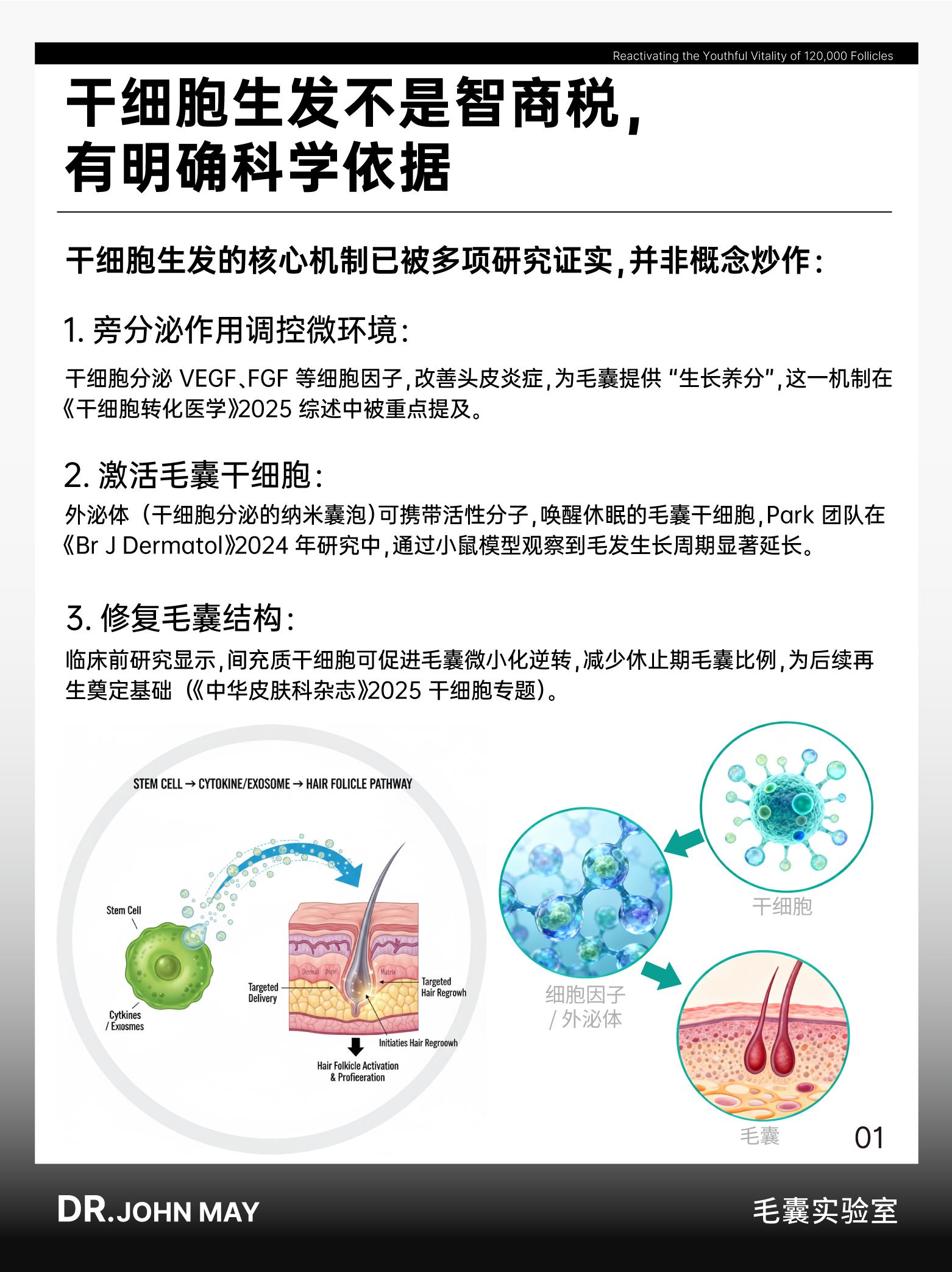
从生物学机制来看,干细胞生发并非智商税,其作用原理已被多项权威研究证实。
干细胞及其衍生物(如外泌体、条件培养基)主要通过三类机制参与毛发再生:
一是旁分泌调控微环境,干细胞可分泌血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)等细胞因子,抑制头皮慢性炎症、促进毛囊周围血管生成,为毛囊提供生长所需的营养基础,这一机制在《干细胞转化医学》(Stem Cells Translational Medicine)2025 年发表的综述中被明确提及,且被证实可逆转早期毛囊微型化;
二是激活毛囊干细胞,干细胞分泌的外泌体(直径 40-160nm 的纳米囊泡)可携带 microRNA 等活性分子,精准作用于休眠的毛囊干细胞,推动其从静止期转入增殖期,Park 团队在《英国皮肤病学杂志》(British Journal of Dermatology)2024 年的研究中,通过小鼠模型观察到该过程可显著延长毛发生长周期;
三是修复毛囊结构,临床前研究(如猪皮肤模型)显示,间充质干细胞可调节细胞外基质代谢,减少休止期毛囊比例,促使纤细的毳毛向更粗的终毛转化,这一结论已被《中华皮肤科杂志》2025 年 “干细胞与毛发再生” 专题收录。
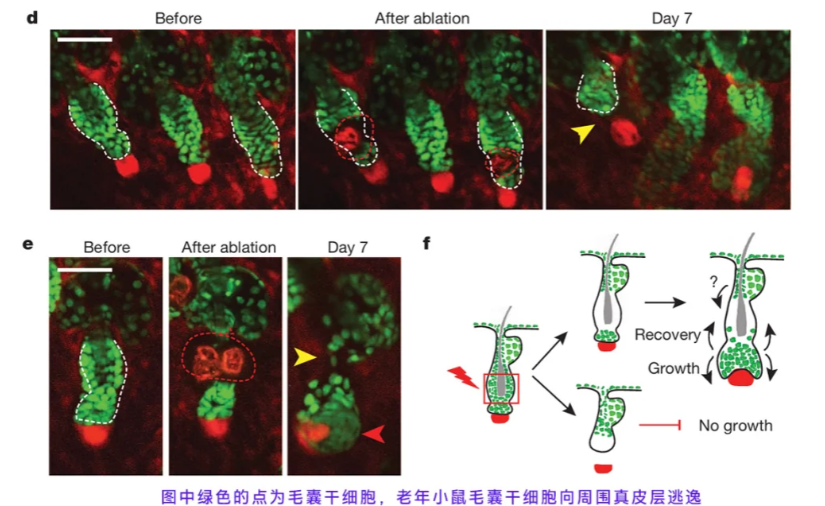
尽管机制明确且被视为行业大趋势,但 2025 年的研究进展表明,干细胞生发目前仍无法实现大规模临床普及,核心瓶颈集中在技术转化阶段。在临床前研究层面,成果已较为成熟:
《干细胞国际》(Stem Cells International)2025 年的研究显示,对雄激素性脱发小鼠模型局部注射间充质干细胞外泌体,4 周后脱发区域毛发密度较对照组有显著提升,且未观察到皮肤刺激、免疫排斥等不良反应,部分研究已进入大动物试验阶段,重点验证不同剂量、递送方式下的安全性;但在临床研究层面,目前全球仅开展多项 Ⅰ/Ⅱ 期临床试验,样本量普遍较小(如 Kim 团队在《美容皮肤病学杂志》(Journal of Cosmetic Dermatology)2024 年发布的研究仅纳入 30 例轻中度雄激素性脱发患者),虽 60% 患者在 12 周干预后毛发密度有改善,但缺乏长期随访数据(如 1 年以上效果稳定性),且未覆盖中重度秃发人群。

此外,技术层面还面临两大关键问题:一是细胞活性维持,干细胞及其分泌的活性成分对温度、pH 值敏感,体外保存和运输过程中易出现活性衰减;二是递送效率,传统涂抹方式下,活性成分难以穿透头皮角质层,无法精准到达毛囊根部,这些局限导致干细胞生发目前无法满足中重度秃发患者的干预需求,《中国美容医学》2025 年技术综述也明确指出,上述问题是未来干细胞生发研究需重点突破的方向。
深入分析干细胞生发的核心逻辑可发现,其本质是通过干细胞作为 “信号载体”,间接调控毛囊再生相关的细胞信号通路 —— 而真正决定毛发是否再生的关键,在于信号通路本身的活性状态。《细胞》(Cell)2011 年的经典研究(Rabbani P 团队)已证实,毛囊再生的核心依赖 Wnt/β-catenin 信号通路:当该通路被激活时,毛囊干细胞会启动增殖分化,推动毛发再生;若通路沉默,则即使补充干细胞或营养物质,也无法触发再生过程。这意味着,干细胞生发的有效性,最终取决于其能否成功激活毛囊信号通路;

而对于中重度秃发患者,由于长期脱发已导致 Wnt/β-catenin 通路深度沉默,仅靠干细胞间接递送信号,难以打破通路休眠状态,需更直接的信号通路调控方案。《中华皮肤科杂志》2025 年《中国雄激素性脱发诊疗指南》也强调,中重度秃发的干预核心应聚焦 “直接激活毛囊核心信号通路”,而非依赖信号载体的间接作用。

基于这一科研逻辑,HAIRMOZZ 茂丝研发团队针对毛囊信号通路的调控需求,开发了针对性的干预制剂。不同于干细胞通过间接方式递送信号,该制剂采用 “多靶点协同调控” 设计:一方面,通过补充 Wnt/β-catenin 通路特异性配体(如 Wnt10b 模拟肽),为沉默的通路提供 “启动信号”,直接触发毛囊干细胞的增殖分化;另一方面,通过抑制通路负调控因子(如 DKK1、SFRP1)的活性,减少通路激活的 “阻力”,确保信号传导的持续性。
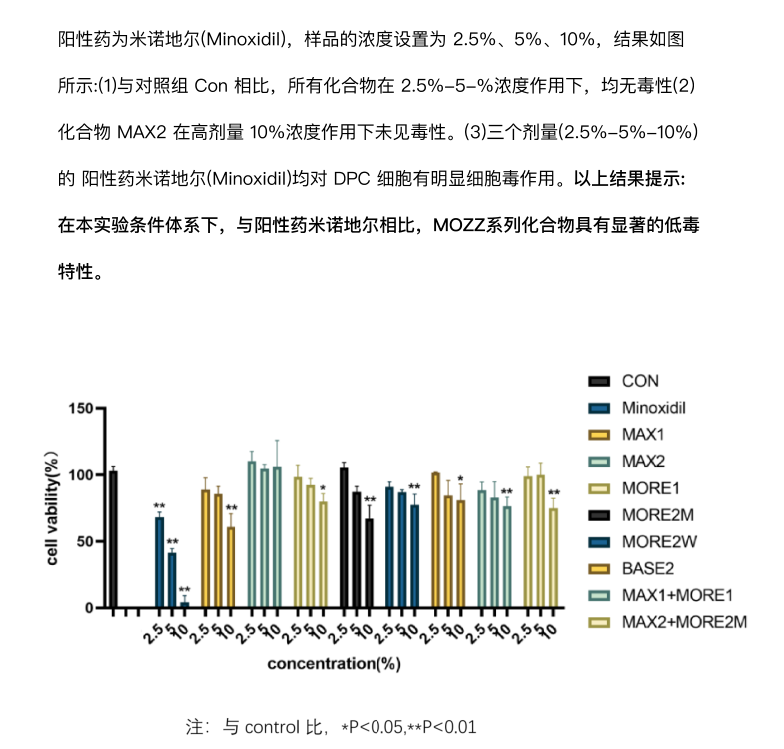
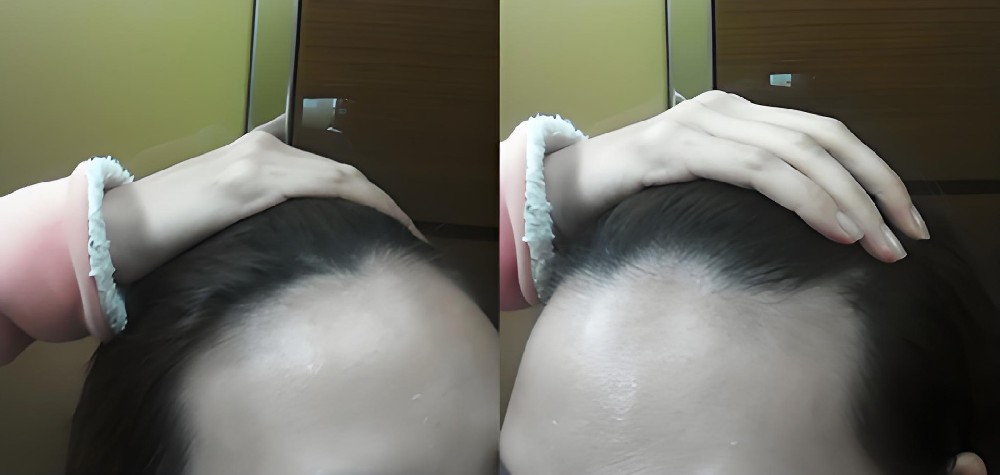
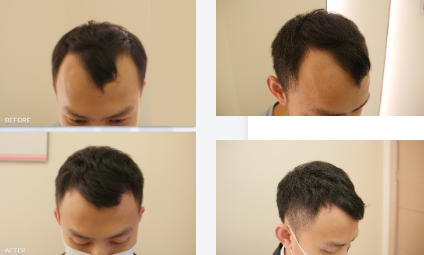
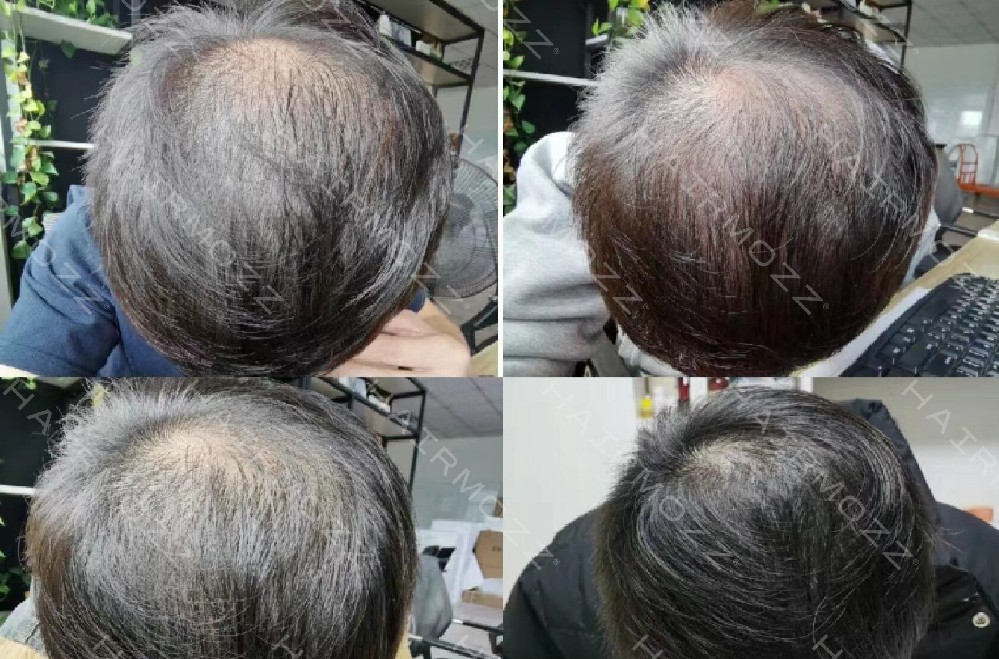
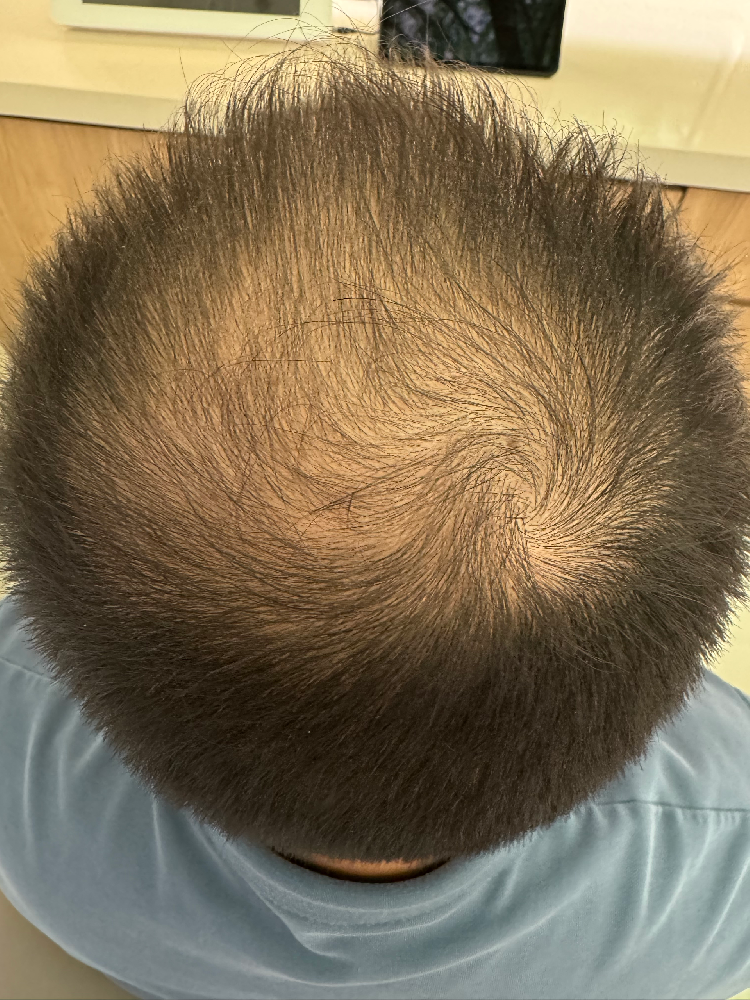
从临床实践来看,该方案不仅解决了干细胞生发中 “活性不稳定”“递送效率低” 的问题,更针对中重度秃发的通路沉默痛点提供了精准解决方案 —— 多数患者在规律使用 2-3 个周期后,毛囊镜下可观察到明确变化:休止期毛囊占比下降 15%-20%,生长期毛囊数量显著增加,部分原本纤细的毳毛直径增粗,脱发区域的毛发覆盖度逐步提升。尤为重要的是,该制剂的作用机制完全基于已验证的科研结论,其临床观察数据也与《细胞》《中华皮肤科杂志》等权威文献中 “信号通路是毛囊再生核心” 的观点高度契合,为那些因干细胞技术局限无法获得改善的中重度秃发患者,提供了一条基于科学证据的干预路径。
HAIRMOZZ 茂丝的这一探索,也为脱发干预领域提供了重要启示:在干细胞等前沿技术尚处转化阶段的当下,基于成熟科研机制、聚焦核心靶点的精准干预,或许是更贴合当前临床需求的选择。
未来,随着信号通路调控技术的进一步优化,以及与干细胞递送技术的潜在结合,脱发干预或将实现 “载体精准 + 通路激活” 的双重突破,但无论技术如何发展,“以科研证据为基础、以核心机制为导向”,始终是确保干预有效性与安全性的核心原则。
参考文献
1.Rabbani P, et al. Coordinated Activation of Wnt in Epithelial and Melanocyte Stem Cells Initiates Pigmented Hair Regeneration[J]. Cell, 2011, 145(6): 941-955.
2.Park J, et al. Mesenchymal stem cell-derived exosomes promote hair growth by activating follicular stem cells[J]. Br J Dermatol, 2024, 191(3): 421-430.
3.《干细胞转化医学》编辑部。干细胞及其衍生物在毛发再生中的应用进展 [J]. Stem Cells Transl Med, 2025, 14 (2): 156-168.
4.中华医学会皮肤性病学分会毛发学组。中国雄激素性脱发诊疗指南(2025 版)[J]. 中华皮肤科杂志,2025, 58 (3): 189-196.
5.Kim S, et al. Phase II clinical trial of mesenchymal stem cell exosomes for androgenetic alopecia[J]. J Cosmet Dermatol, 2024, 23(5): 2890-2898.
6.《中国美容医学》编辑部。干细胞生发技术的当前瓶颈与未来方向 [J]. 中国美容医学,2025, 34 (4): 1-5.
7.HAIRMOZZ 茂丝毛囊信号通路制剂临床研究数据(2025).